
Package documentaire complet ISO/CEI 17025
Laboratoires d'étalonnage et d'essais
Le kit documentaire complet
pour mettre en place l’ISO/CEI 17025
dans les laboratoires d’étalonnages et d’essais
Offre limitée : Bénéficier d’une réduction de 50 %
Prix : 589 €
Au lieu de 1178 €
Le kit ISO/CEI 17025 version 2017 est un kit de documents complet qui permet même aux débutants de mettre en place un système de management pour se conformer aux exigences générales concernant la compétence des laboratoires d’étalonnages et d’essais.
Le package complet ISO/CEI 17025 version 2017 est un kit de documents complet qui contient tout, allant de tous les modèles des procédures, des processus, des formulaires, des listes de contrôle, des outils, des guides détaillés et des instructions nécessaires pour :
- Lancer votre démarche ISO/CEI 17025.
- Créer votre documentation ISO/CEI 17025.
- Accéder rapidement à l’accréditation ISO/CEI 17025.
- Bénéficier d’un système de management ISO/CEI 17025 simple et adapté aux besoins de votre laboratoire.

Économisez du temps
Pourquoi commencer avec une page blanche, commencez votre projet aujourd'hui et économisez jusqu'à 80% de votre temps et de votre argent.

Consultation en ligne
Vous pouvez soumettre deux documents pour une vérification gratuite par des experts, profiter aussi d'un service de mise à jour régulier.

Réduire le budget
Mise en œuvre rentable: beaucoup moins cher qu'un consultant sur site, et nécessite beaucoup moins de temps que de le faire à partir de zéro
Le package complet pour l'ISO/CEI 17025 version 2017
• Une valeur ajoutée : Toutes les exigences de l’ISO/CEI 17025 2017 ont été développées en un processus efficace qui ajoute une valeur opérationnelle à votre laboratoire et augmente par conséquent votre productivité.
• Efficience : Un effort minimal est requis pour suivre les procédures nécessaires pour se conformer à toutes les exigences de la norme ISO/CEI 17025.
• Simplifié : La bureaucratie et les formalités administratives excessives ont été éliminées de la documentation pour faciliter les choses – tout en restant totalement conforme à la norme ISO/CEI 17025 2017.
Commencer votre porjet aujourd’hui, et économisez jusqu’à 80% de votre temps et de votre argent.
Le package documentaire tout-en-un pour l'ISO/CEI 17025 version 2017

Manuel et politique qualité
– Manuel qualité ISO/CEI 17025 version 2017
– Politique qualité

Exigences structurelles
– Domaine d’application
– Procédure de gestion des ressources humaines
– Procédure formation personnel
– Matrice interaction Personne/activités
– Plan de formation
– Fiche d’évaluation à chaud de la formation
– Fiche d’évaluation à froid de la formation

Exigences de process
- Examen de contrats
– Procédure de contractualisation avec le client
– Procédure de choix et validation des règles de décision
– Demande d’analyse / test / étalonnage
- Sélection, vérification et validation des méthodes
– Procédure de validation des méthodes d’essai ou d’étalonnage
– Fiche de validation des méthodes d’essai ou d’étalonnage
– Rapport de validation d’essai ou d’étalonnage
- Échantillonnage
– Procédure de gestion des échantillons
– Fiche de contrôle à la réception
- Manipulation des produits d’essais ou d’étalonnage
– Procédure de transport et manutention des échantillons
- Évaluation de l’incertitude de mesure
– Procédure d’évaluation de l’incertitude de la mesure
– Bilan d’incertitude
- Gestion des réclamations
– Procédure de traitement des réclamations clients
– Enquête de satisfaction client
- Gestion des non conformités
– Procédure de traitement des non-conformités & actions correctives
– Fiche de non-conformité
- Maîtrise de la conformité des résultats
– Procédure de maîtrise de la conformité des résultats
- Maîtrise des données et management de l’information
– Procédure maîtrise des données et management de l’information
- Préparation des rapports des résultats
– Procédure de préparation et validation des rapports de résultats
– Exemple de rapport de résultats

Exigences générales
- Impartialité :
– Procédure d’impartialité
– Engagement d’impartialité
– Évaluation des risques sur l’impartialité
- Confidentialité
– Politique de confidentialité
– Engagement de confidentialité

Exigences de ressources
- Personnel
– Processus gestion des ressources humaines
– Procédure compétence, formation et sensibilisation
– Évaluation de la formation
– Examen de compétence
- Conditions ambiantes
– Fiche de contrôle des conditions ambiantes.
- Equipement
– Procédure de gestion des équipements
– Inventaire des équipements
– Fiche de vie équipement
– Fiche d’anomalie équipement
- Traçabilité métrologique
– Procédure d’étalonnage des équipements de mesure
– Procédure de traitement de matériaux de référence
– Programme d’étalonnage
- Achat et prestataires externes
– Procédure achats de service, de fournitures et de matériaux
– Liste et évaluation des sous-traitants
– Questionnaire évaluation des sous-traitants

Exigences du système de Management (Option A)
– Procédure de gestion des documents et des enregistrements
– Plan d’amélioration qualité
– Procédure audit interne
– Calendrier annuel d’audit
– Rapport d’audit Interne
– Plan d’audit
– Procédure revue de direction
– Rapport de revue de direction
– Procédure de matrise des risques et des opportunités.

Les modifications apportées à l'ISO/CEI 17025 2017
En novembre 2017, les exigences générales de l’ISO/CEI 17025 2017 relatives à la compétence des laboratoires d’étalonnages et d’essais ont été publiées. On vous rappelle que tous les laboratoires accrédités doivent adopter la nouvelle norme d’ici la fin de 2020, la date limite est de trois ans après la publication de la version finale.
La nouvelle version comprend des différences majeures par rapport à la structuration, la formulation et la mise en forme des chapitres de la norme.
Managementqualite.com a créé son propre tableau de références croisées pour aider les laboratoires à identifier les différences spécifiques entre les deux versions.
Les changement de structure:
La nouvelle structure de la norme ne repose plus sur deux chapitres principaux: Elle se compose désormais de cinq chapitres pour les exigences techniques et deux chapitres pour les exigences de management.
La nouvelle norme comprend des exigences de structure, des exigences de ressources, des exigences de processus et des exigences du système de management.
La norme comprend deux annexes non introduites dans la version précédente:
• Annexe A informative, relative à la traçabilité métrologique.
• Annexe B informative, relative aux différentes options du système de management de laboratoire.
Les changements de structure

Chapitre 4: EXIGENCES GÉNÉRALES
4.1 Impartialité
ISO/CEI 17025 2017définit le mot «impartialité» comme la «présence d’objectivité». Par «objectivité», on entend que «les conflits d’intérêts n’existent pas ou sont résolus de manière à ne pas nuire aux activités ultérieures du laboratoire».
Toute pression exercée sur les personnes impliquées ne peut pas influencer les activités de laboratoire. De même, les résultats des laboratoires d’essais ou d’étalonnage ne peuvent pas sembler altérés par les relations que le laboratoire ou les personnes impliquées dans les activités de laboratoire peuvent avoir avec le client.
• Les laboratoires doivent créer une structure pour déterminer, analyser et gérer les risques potentiels d’impartialité et minimiser les pressions en protégeant l’impartialité.
• Les laboratoires doivent montrer comment atténuer ou éliminer les risques. Les risques peuvent provenir des activités et des relations du personnel de laboratoire.
• Les laboratoires doivent concevoir et mettre en œuvre un plan d’action pertinent pour assurer leur impartialité.
• Les laboratoires doivent s’engager pour l’intégrité en signant une déclaration officielle d’impartialité et de confidentialité
Ces mesures doivent être examinées lors de la revue de direction et révisées si nécessaire.
4.2 Confidentialité
Le laboratoire assume la responsabilité de la gestion de toutes les informations acquises au cours de ses activités, conformément aux engagements juridiquement contraignants.
Les clients doivent être informés par écrit si le laboratoire exprime le souhait de mettre des informations sur une mission à la disposition du public. Le personnel du laboratoire, le personnel externe et les fournisseurs doivent également accepter et signer une déclaration de confidentialité.
Chapitre 5. EXIGENCES STRUCTURELLES
La réforme des exigences structurelles comprend les modifications importantes suivantes:
• Les termes «responsable qualité» et «responsable technique» ne sont pas mentionnés, mais les fonctions restent dans la norme. De plus, il n’est plus impératif que les postes clés aient des remplaçants.
• Le laboratoire est tenu de rédiger toute une gamme d’activités pour définir le domaine d’application de la norme , mais n’inclut pas les activités sous-traitées en permanence.
En suivant les nouvelles exigences de la norme ISO 9001: 2015, des processus de communication suffisants concernant l’efficacité du système de management sont également nécessaires.
Chapitre 6: EXIGENCES RELATIVES AUX RESSOURCES
6.2 Personnel
Il n’y a pas de changements substantiels, mais les plus notables incluent:
• Prise en charge avant autorisation et surveillance après autorisation du personnel.
• Supprimer l’évaluation de l’efficacité de la formation.
• Éliminer la documentation des descriptions de travail et des fiches de postes, mais il est nécessaire de définir les compétences requises pour chaque fonction, y compris les fonctions de management et celles ayant une incidence sur les résultats du laboratoire.
Les échantillons aveugles, les comparaisons inter / intra-laboratoires, les échantillons inter-comparaisons, les étalons de référence et les examens sont les méthodes de surveillance ou de supervision les plus fréquemment utilisées pour le personnel.
6.3 Installations et conditions ambiantes
Les installations et l’environnement ambiant ne subissent aucun changement important. Cependant, la nouvelle norme oblige à respecter les exigences relatives à l’environnement et aux installations lorsque des tests sont effectués dans des installations indépendantes du laboratoire.
6.4 Équipements
Les équipements englobent désormais les logiciels, les réactifs et les matériaux de référence. L’équipement doit être étalonné si sa précision peut avoir une incidence sur la validité des résultats et si un étalonnage est nécessaire pour assurer la traçabilité métrologique.
Notez que la référence à l’ISO 17034 a été ajoutée pour mettre en évidence la compétence des fournisseurs de matériaux de référence.
6.5 Traçabilité métrologique
Une nouvelle annexe informative sur la traçabilité métrologique a été créée, tandis que la plupart des notes ont été effacées. Dans l’Annexe A, des possibilités ont été ajoutées sur la manière de déterminer et de montrer la traçabilité:
– Par l’utilisation d’un NMI.
– Par un laboratoire d’étalonnage accrédité.
Si possible, il est plus facile et rentable pour les laboratoires d’utiliser des laboratoires nationaux de métrologie ou des laboratoires d’étalonnage accrédités. Sinon, un laboratoire peut choisir d’évaluer sa compétence en métrologie sur la base de la norme ISO/CEI 17025.
6.6 Produits et services fournis par des prestataires externes
Cette nouvelle clause reprend le concept précédent de la sous-traitance, ce qui signifie que la sous-traitance et les achats sont désormais regroupés dans une même clause.
Le laboratoire doit disposer d’un système permettant de sélectionner, évaluer, surveiller et réévaluer les prestataires externes. Il doit également veiller à ce que tous les produits et services achetés répondent aux exigences.
Enfin, le laboratoire doit indiquer clairement aux prestataires son achat, les critères d’acceptation, les compétences requises du personnel et les activités à exécuter dans les locaux du prestataire.
Chapitre 7: Exigences relatives aux processus
7.1 Revue des demandes, appels d'offres et contrats
Le laboratoire devrait avoir une procédure pour les examens, les demandes, les offres et les contrats. La documentation de cette procédure est également nécessaire. Elle comprend les mesures suivantes:
• Informer le client lorsque la méthode demandée par le client est obsolète ou inappropriée.
• Avoir une définition claire d’une déclaration de conformité à la demande du client.
• Régler toute différence entre le contrat et l’offre ou la demande avant de commencer les travaux.
• Informer le client des écarts par rapport au contrat.
• Répéter la revue du contrat s’il est modifié après le travail et communiquer à tout le personnel concerné.
• Coordonner avec les clients ou leurs représentants pour répondre à une demande et pour vérifier la performance du laboratoire associée au travail effectué.
• Tenir des registres des examens et les conserver.
7.2 Sélection, vérification et validation des méthodes
Le laboratoire doit utiliser des procédures et méthodes appropriées pour toutes ses activités. Les procédures, méthodes et documents justificatifs doivent être mis à jour, conservés et mis à la disposition du personnel.
En outre, le laboratoire doit utiliser la dernière version des méthodes, à moins que cela ne soit pas possible. Il doit également choisir une procédure appropriée lorsque le client n’a pas été en mesure de la spécifier.
Le laboratoire doit vérifier les méthodes avant de les introduire pour s’assurer qu’elles peuvent atteindre les performances requises. Outre un plan d’action pour le développement de méthodes, le laboratoire doit valider les méthodes développées en interne, les méthodes standard et les méthodes non standard utilisées en dehors du domaine visé.
En cas de dérogation aux méthodes, le client doit la documenter, la justifier techniquement, l’autoriser et l’accepter. En règle générale, le laboratoire doit conserver des enregistrements de validation des méthodes utilisées.
7.3 Échantillonnage
Le laboratoire doit disposer d’une méthode d’échantillonnage et d’un plan d’échantillonnage lorsqu’il procède à l’échantillonnage de produits, de matériaux ou de substances en vue d’un étalonnage ou de tests ultérieurs.
Pour garantir la légitimité des étalonnages ou des essais ultérieurs, la méthode d’échantillonnage doit aborder les aspects à contrôler. Le laboratoire doit conserver des enregistrements relatifs à l’échantillonnage.
7.4 Manutention des objets d’essai ou d'étalonnage
Le laboratoire doit avoir une procédure pour la manutention, la réception, la conservation, le stockage, la protection, le transport, la mise au rebut et la restitution des éléments d’étalonnage ou des essais, y compris toutes les dispositions nécessaires pour protéger l’intégrité de l’élément et pour protéger les intérêts des clients et du laboratoire.
De même, des précautions doivent être prises pour éviter la contamination, la détérioration, la perte et les dommages à l’objet lors de la manutention, du stockage, de l’attente, du transport et de la préparation en vue de l’étalonnage ou de l’essai. Les instructions de manipulation fournies avec l’objet doivent être suivies.
Le laboratoire doit disposer d’un système permettant d’identifier sans ambiguïté les éléments d’étalonnage et des essais. L’identification doit être conservée tant que l’objet est sous la responsabilité du laboratoire. Le laboratoire doit conserver des enregistrements relatifs aux objets d’essai ou d’étalonnage.
7.5 Enregistrements techniques
Il s’agit des informations adéquates du suivi de toutes modifications apportées aux observations originales ou aux versions précédentes.
Pour expliquer davantage, le laboratoire doit s’assurer que les enregistrements techniques des activités du laboratoire incluent des résultats et des rapports suffisants. Il doit couvrir les informations pour faciliter et identifier les facteurs affectant le résultat de la mesure et l’incertitude de mesure associée, et permettre la répétition de l’activité du laboratoire dans des conditions aussi proches que possible de l’original.
Les enregistrements techniques doivent inclure la date et l’identité du personnel responsable de chaque activité, telle que la vérification des données et des résultats.
7.6 Evaluation de l'incertitude de mesure
7.7 Assurer la validité des résultats
Le laboratoire est responsable de la mise en place d’une procédure de contrôle de la validité des résultats. Cela inclut la vérification des performances par comparaison avec les résultats d’autres laboratoires.
De plus, le laboratoire doit analyser et utiliser les données de la surveillance pour contrôler et améliorer ses activités. Enfin, il doit agir lorsque les données de la surveillance ne correspondent pas à des critères prédéfinis.
7.8 Rapport sur les résultats
-Création d’un paragraphe (§7.8.5) d’exigences sur la constitution des rapports d’échantillonnage
-Création d’un paragraphe (§7.8.6) d’exigences sur les déclarations de conformité (commun à l’ensemble des activités), comprenant l’identification de la règle de décision, la prise en compte du niveau de risque.
-Les données fournies par un client doivent être clairement identifiées. Une exonération de responsabilité doit en outre être ajoutée dans le rapport lorsque les informations sont fournies par le client et qu’elles peuvent affecter la validité des résultats.
-Possibilité de rendre des avis et interprétations (si approprié) pour les activités d’étalonnage.
Les résultats doivent être revus et approuvés avant transmission du rapport.
La liste des données constitutives du rapport a été complétée (date d’émission, l’identification claire des résultats provenant de prestataires externes..).
Lorsqu’un rapport émis doit être remplacé, amendé ou réémis, toute modification d’informations doit être clairement identifiée et, le cas échéant, l’explication de cette modification est à ajouter au rapport.
7.9 Réclamations
Sur demande, la mise à disposition pour toute partie intéressée de la description du processus de traitement des réclamations.
Le processus documenté doit comprendre notamment l’accusé de réception, le suivi, la collecte et la vérification des informations, les conclusions, et les actions appropriées…
Les conclusions doivent être établies ou revues et approuvées, par une ou des personnes n’ayant pas été impliquées dans les activités de laboratoire initialement en cause.
7.10 Travaux non conformes
La procédure doit assurer que :
– Une évaluation de l’importance des travaux non conformes est effectuée, y compris une analyse d’impact sur les résultats précédents.
– Les actions requises (y compris l’arrêt ou la reprise des travaux et la rétention des rapports, s’il y a lieu) s’appuient sur les niveaux de risque fixés par le laboratoire.
7.11 Maîtrise des données et gestion de l’information
Lorsque le système de gestion de l’information d’un laboratoire est géré et entretenu hors site ou l’est par un prestataire externe, le laboratoire doit assurer que le prestataire ou l’opérateur du système satisfait à toutes les exigences applicables de la norme.
Accessibilité des manuels ou instructions pour l’utilisation des systèmes de gestion de l’information .
Le ou les systèmes de gestion de l’information du laboratoire utilisés pour la collecte, le traitement, l’enregistrement, la transmission, le stockage ou la récupération de données doivent être validés en termes de fonctionnalité, y compris le bon fonctionnement des interfaces au sein du ou des systèmes de gestion de l’information du laboratoire, par le laboratoire, avant mise en service
Chapitre 8: EXIGENCES DU SYSTÈME DE MANAGEMENT
8.1.2 l'option A
Le système de management du laboratoire doit traiter les points suivants:
• La documentation du système de management (voir 8.2).
• Le contrôle des documents du système de management (voir 8.3).
• Le contrôle des enregistrements (voir 8.4).
• Les actions visant à gérer les risques et les opportunités (voir 8.5).
• L’amélioration (voir 8.6).
• Les actions correctives (voir 8.7).
• Les audits internes (voir 8.8).
• Les revues de direction (voir 8.9).
8.1.3 l'option B
Un laboratoire respecte les exigences du système de management spécifiées aux 8.2 à 8.9 au moins s’il:
• a défini et conserve un système de management conforme aux exigences de la norme ISO 9001.
• est capable de soutenir et de prouver le respect constant des exigences des clauses 4 à 7.

Pendant les 30 premiers jours de votre achat, si vous n’êtes pas satisfait pour une raison quelconque, contactez simplement support@managementquelite.com et notre équipe de support vous enverra un remboursement immédiat et complet.
Le package documentaire comprend tous les documents dont vous avez besoin pour être conforme à la norme ISO/CEI 17025– ces documents sont entièrement acceptable par l’audit d’accréditation.
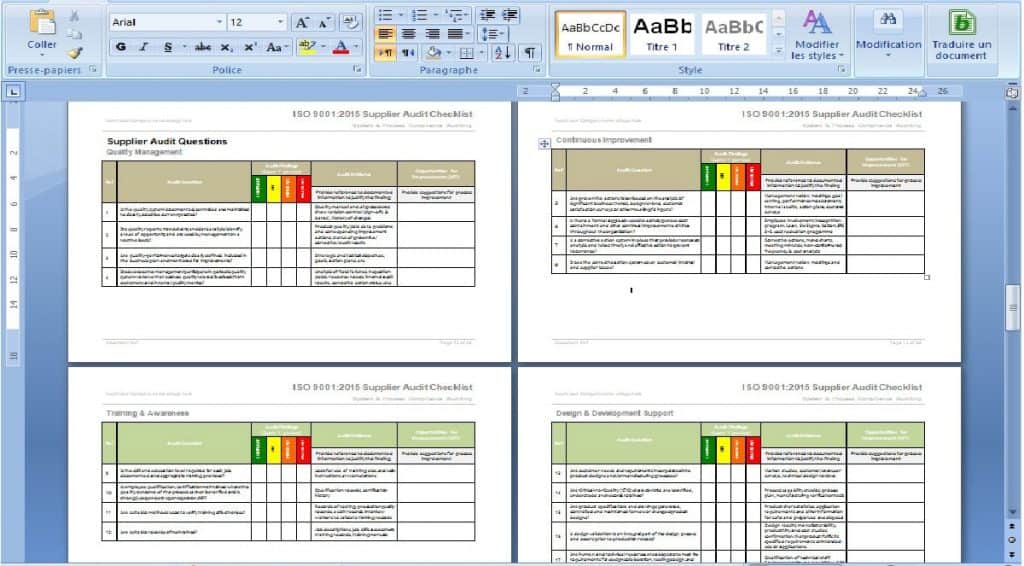

Nous avons déjà complété environ 90% des informations demandées sur les documents. Pour les compléter vous devez renseigner uniquement le nom de l’entreprise, les parties responsables, et toute autre information unique à votre entreprise. vous serez guidé à travers le processus, moyennant les commentaires sur les éléments qui sont nécessaires et ceux qui sont facultatifs.
Nous avons travaillé sur la documentation ISO/CEI 17025, de sorte pour assurer tous ses utilisateurs qu’ils ont tout complété avec précision et avec la plus grande efficacité.
Tous les documents sont faits de sorte que vous pouvez suivre parfaitement l’ordre proposé, ce qui vous permet de vous assurer que rien ne manque, et que personne ne se perd dans le processus.
Les commentaires et les logigrammes inclus aident votre personnel à comprendre chaque document et son utilité ce qui vous aide à rendre le management de votre laboratoire plus fluide, et les processus plus faciles à suivre.

Tous les documents sont en MS Word ou MS Excel, pour les rendre très faciles à personnaliser pour votre entreprise. Vous pouvez les personnaliser en ajoutant des logos d’entreprise et des couleurs, et modifier les en-têtes et pieds de page pour correspondre à votre style préféré.
Caractéristiques du Kit complet ISO/CEI 17025
– Prix: 589 € en promotion.
– Documentation incluse : 60 documents pour la mise en place de ISO/CEI 17025
– Format MS Office 2007, MS Office 2010, MS Office 2013, MS Office 2016.
– Langue de la documentation : française, disponible aussi en anglais.
– Les documents sont entièrement modifiables – il vous suffit d’entrer les informations spécifiques à votre entreprise.
– Acceptable pour l’audit d’accréditation ISO/CEI 17025 ? Oui, tous les documents requis par l’ISO/CEI 17025 sont inclus, ainsi que la politique qualité et les procédures courantes mais optionnelles.
Livraison instantanée – Le package est téléchargeable immédiatement après l’achat
Consultation gratuite – De plus vous pouvez soumettre deux documents complets pour une révision par des professionnels.
Créé pour votre laboratoire – Les modèles sont optimisés pour les petites et moyennes entreprises.

Package documentaire complet ISO/CEI 17025
Laboratoires d'étalonnage et d'essais
Version 2017
Le kit documentaire complet
pour mettre en place l’ISO/CEI 17025
dans les laboratoires d’étalonnages et d’essais
Prix : 589 €
Au lieu de 1178 €
Notre laboratoire a été sous la pression des clients pour obtenir une accréditation ISO / CEI 17025.
Heureusement, nous avons découvert managementqualite.com car le cabinet a pu nous aider à appliquer les exigences de la norme ISO 17025 et satisfaire nos clients.
Nous avons développé notre système autour des exigences de la norme en utilisant le package simplifié de managementqualite.com, ce qui a permis à nos employés d’apprendre énormément sur la manière de se conformer aux exigences.
Un de mes collègues du secteur a recommandé managementqualite.com pour nous aider dans notre démarche d’accréditation.
Après avoir examiné les packages et évalué les avis des clients, notre direction a décidé de se procurer des kits auprès de managementqualite.com afin de pouvoir obtenir rapidement l’accréditation ISO / CEI 17025.
En effet, les consultants de managementqualite.com ont été très expérimentés, même si les documents qu’ils ont fournis sont bien expliqués et très détaillés.

Contactez nous: Support@managementqualite.com
https://www.managementqualite.com/








